Essa postagem foi feita com base no livro:
Organic Chemistry dos autores Jonathan Clayden, Nick Greeves e Stuart Warren.
Fontes das fotos usadas para fazer o esquema acima:
Porque as moléculas têm essas formas? Quais propriedades dos átomos constituintes dessa molécula que ditam a forma da molécula? Respondendo a estas perguntas poderemos não apenas prever a estrutura da molécula, mas também predizer e explicar a reatividade da molécula.
Primeiramente, precisamos entender porque os átomos se juntam para formar moléculas. A maioria dos átomos da tabela periódica são mais estáveis em moléculas do que como átomos livres, entretanto, alguns átomos (como os "gases nobres") evitam formar ligações.
Os átomos se juntam porque a carga positiva do núcleo atrai a carga negativa dos elétrons. O número de elétrons que determina a forma das moléculas.
Por exemplo: o metano (CH4) possui 6 elétrons do átomo de carbono e 1 elétron de cada átomo de hidrogênio (totalizando 4 elétrons dos 4 átomos de hidrogênios); então o metano tem 10 elétrons e um arranjo tetraédrico.
A amônia (NH3) possui 7 elétrons do átomo de nitrogênio e 3 elétrons dos 3 átomos de hidrogênio (cada hidrogênio tem um elétron); então, a amônia tem 10 elétrons e o arranjo também é tetraédrico.
A molécula de água (H2O) possui 8 elétrons do átomo de oxigênio e 2 elétrons dos dois átomos de hidrogênio; então, a água tem 10 elétrons, e um arranjo tetraédrico.
Espectro de emissão atômica
Muitas cidades possuem postes com lâmpadas com vapor de sódio que emitem uma luz amarelo-alaranjada. Dentro dessas lâmpadas temos o sódio metálico e quando a corrente elétrica passa pelo vapor de sódio, emite uma luz alaranjada. A mesma luz emitida no teste da chama com o sódio.

Fonte da foto: http://professordiegomarcon.blogspot.com/2014/08/teste-de-chama-e-modelos-atomicos.html
A chama emitida pela discarga elétrica da lâmpada oferece energia para promover elétrons para níveis mais altos de energia dentro do átomo. Quando esse elétron volta para onde ele estava, libera energia na forma de luz. Se você colocar essa luz em um prisma para medir a refração da luz e calcular o comprimento de onda da luz emitida, verá que o espectro estará na faixa de 600nm.

https://gerenciamentodecor.wordpress.com/category/sem-categoria/ nesse site tem informações interessantes sobre cores de impressão, uma boa teoria.
Elétrons possuem níveis quantizados de energia.
O espectro de absorção do hidrogênio foi medido em 1885 pelo suiço Johann Balmer, que também notou que o comprimento de onda dessas linhas no espectro podiam ser medidos por uma fórmula matemática.
Elétrons ocupam níveis de energia precisamente determinados, ou seja, a energia de um elétron orbitando um próton é quantizada.
Entretanto, o elétron e o fóton tem características tanto de onda, quanto de partícula. Assim, se imaginarmos o elétron viajando como a energia em uma corda balançando, podemos ter essa corda fazendo um único balão, sendo esse o estado fundamental, ou seja, a menor energia para fazer essa corda balançar. Se balançarmos mais forte, com mais energia, essa corda poderá ter dois balões e um nó estacionário no meio. Com mais energia, maior a frequência, então, podemos dar mais energia e ter maiores frequências com menores comprimentos de ondas.
Da mesma forma em que essa corda vibra, os elétrons também tem comprimentos de ondas e frequências associados a uma energia. E essa energia é quantidade, pois será a energia necessária para aumentar a frequência de vibração da onda.
Elétrons ocupam orbitais atômicos
Elétrons nunca podem ser precisamente localizados. De acordo com o Princípio de Incerteza de Heisenberg, nunca sabemos ao mesmo tempo a localização e o momentum (movimentação) de um elétron. Assim, devemos pensar na probabilidade de se encontrar um elétron em um lugar em um certo tempo. Calculando essas probabilidades, temos uma imagem do habitat dos elétrons, como se fosse uma imagem borrada de uma corda balançando. Como os elétrons podem se mover em três dimensões (para cima e baixo, um lado e outro, frente e trás), essa imagem deve ser em três dimensões. Essa região é chamada de orbital, se o orbital estiver representando os elétrons de um átomo é chamado orbital atômico, se forem os elétrons de uma molécula, são chamados de orbitais moleculares.
A forma desses orbitais é determinada matematicamente por funções de onda. O formato do orbital 1s é esférico, com o centro no núcleo do átomo, assim como o orbital 2s também é esférico com o centro no núcleo do átomo. Entretanto, o orbital 2s é maior que o 1s e existe um nó (ponto em que nenhuma movimentação é observada) entre o orbital 1s e 2s; podendo ser representados como as camadas de uma cebola. O orbital 2s tem mais energia que o orbital 1s.
Podemos representar cada orbital como uma linha em uma altura do diagrama de nível de energia, quanto mais para cima essa linha estiver, mais energia o orbital possui. Representamos os elétrons como uma seta vertical em cima dessa linha e a direção da seta representa os spins dos elétrons que são opostos. Cada orbital pode possuir no máximo dois elétrons com spins opostos.
O orbital p tem um nó em um plano, seu formato parece o símbolo do infinito e cada um dos três orbitais p é direcional, apontando ao longo dos três eixos e chamados px, py, pz de acordo com o eixo que ele está localizado. Como eles tem a mesma energia, devem ficar lado a lado no diagrama de níveis de energia. Entretanto, como o núcleo atrai os elétrons, quanto mais elétrons um orbital tem, mais atraído pelo núcleo, logo menor energia ele terá. Assim, o o neônio que tem 10 elétrons tem todos os orbitais cheios, diminuindo a energia dos orbitais e deixando o átomo muito estável pela atração dos elétrons ao núcleo. O neônio possui o orbital 1 s cheio com 2 elétrons, o orbital 2s cheio com 2 elétrons e os 3 orbitais p cheios, cada um com 2 elétrons, sendo extremamente estável e evitando formar ligações químicas.
Orbitais moleculares e interações de ondas: orbital ligante e anti-ligante
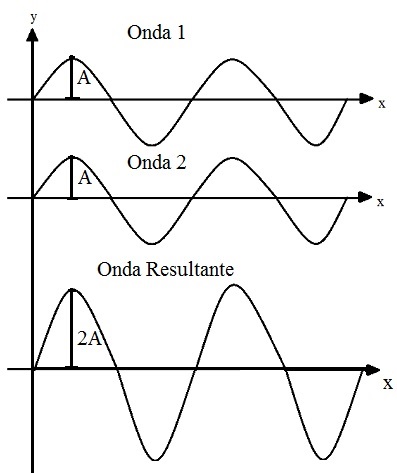
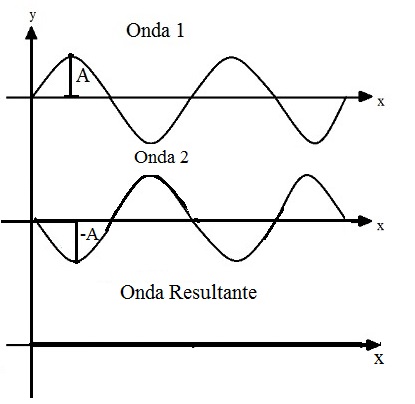
Um orbital pode ser representado por uma onda, então quando um orbital atômico interage com outro orbital atômico para formar um orbital molecular, podemos analisar como se fossem duas ondas se encontrando. Assim, as combinações de ondas em fase (com as duas cristas ou os dois vales na mesma direção) geram interações construtivas e interações fora de fase geram interações destrutivas.
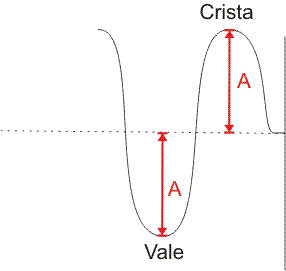
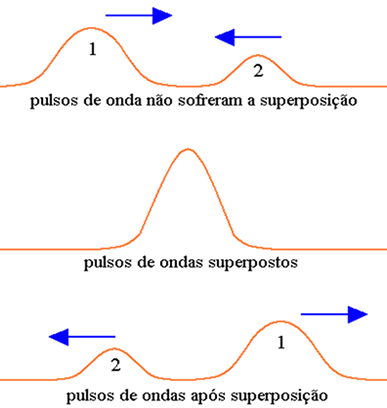

O mesmo ocorre com os orbitais. Orbitais atômicos que interagem em fase tem uma interação construtiva, gerando um orbital molecular ligante (σ). Orbitais atômicos que interagem fora de fase tem uma interação destrutiva que gera um orbital molecular anti-ligante (σ*). Assim, cada orbital molecular é formado por dois orbitais atômicos, que dão origem ao orbital molecular ligante e ao orbital molecular anti-ligante.
.
Fonte com aleteração: http://www.docentes.ipt.pt/valentim/ensino/TOM_licao2.pdf
Porque os orbitais ligantes contribuem para a formação da ligação química entre os átomos?
O orbital molecular resultante pertence aos dois átomos. Para colocar os elétrons nos orbitais moleculares, primeiro colocamos no orbital moleculares de menor energia vazio.
Lembrando que cargas iguais se repelem e cargas opostas se atraem. Quando os elétrons (carga negativa) estão entre os núcleos são atraídos pelos dois núcleos (carga positiva), segurando-os juntos no orbital molecular ligante, que é mais estável e é um orbital com menor energia.
O contrário ocorre no orbital molecular anti-ligante em que os elétrons estão em qualquer lugar que não entre os núcleos, então ocorre grande repulsão entre os núcleos positivos, dificultando a ligação química. Assim, se um átomo tiver o mesmo número de elétrons nos orbitais ligantes e anti-ligantes, eles não tendem a formar moléculas, como é o caso do hélio (He2), que tem dois elétrons no orbital ligante e dois no orbital anti-ligante, assim, qualquer elétron no orbital ligante é cancelado pelo orbital anti-ligante e a molécula He2 se desfaz.
A figura abaixo ilustra a formação de um orbital molecular ligante ou anti-ligante. feita pela interação de dois orbitais atômicos s.
A figura abaixo ilustra a formação de um orbital molecular ligante ou anti-ligante. feita pela interação de dois orbitais atômicos s.
Ordem de ligação
Se houver mais elétrons nos orbitais moleculares ligantes que nos anti-ligantes, haverá ligação químics. A ordem de ligação define o número de ligações entre dois átomos. Fórmula:
Ordem de ligação= (número de elétrons no orbital molecular ligante - nímero de elétrons no orbital molecular anti-ligante)/2
Ou seja: ordem de ligação é elétron ligante menos anti-ligante dividido por dois.
Uso de orbitais atômicos p para formar orbitais sigma (σ) e pi (π).
A figura acima que mostra a orbitais s (esféricos) formando de orbitais moleculares ligante e anti-ligante não se aplica para os orbitais p, pois o formato deles é completamente diferente.

Foto: https://www.quora.com/What-are-Px-Py-and-Pz
Foto: https://www.quora.com/What-are-Px-Py-and-Pz
Orbitais p ligados ponta a ponta fazem uma ligação sigma (σ), ligação frontal.
Orbitais p ligados lado a lado fazem ligações pi (π), ligação lateral.
As ligações sigma (σ) são mais fortes que as ligações pi (π). As ligações sigma tem maior sobreposição dos orbitais atômicos p para a formação do orbital molecular sigma.
Há maior sobreposição entre orbitais do mesmo tamanho, ou seja 2p com 2p sobrepõe melhor do que 2p com 3p. Logo, os orbitais moleculares formados orbitais atômicos 2p com 2p são mais estáveis, a ligação é mais forte e mais difícil de ser rompida. Outra observação é que não é possível sobrepor orbitais px com py ou pz, só é possível sobrepor px com px ou a ponta do px com um orbital s.
Esses orbitais podem se combinar em fase ou fora de fase.
As ligações sigma (σ) são mais fortes que as ligações pi (π). As ligações sigma tem maior sobreposição dos orbitais atômicos p para a formação do orbital molecular sigma.
Há maior sobreposição entre orbitais do mesmo tamanho, ou seja 2p com 2p sobrepõe melhor do que 2p com 3p. Logo, os orbitais moleculares formados orbitais atômicos 2p com 2p são mais estáveis, a ligação é mais forte e mais difícil de ser rompida. Outra observação é que não é possível sobrepor orbitais px com py ou pz, só é possível sobrepor px com px ou a ponta do px com um orbital s.
Esses orbitais podem se combinar em fase ou fora de fase.
Ligações entre átomos diferentes
A atração ao núcleo depende da carga nuclear. Quanto maior o número de prótons (número atômico), maior a atração, então os elétrons estarão mais firmemente atraídos ao núcleo, mais estáveis e com mais baixa energia. Essa é a origem da eletronegatividade: quanto mais eletronegativo um átomo for, mais o núcleo atrai os elétrons, então os orbitais atômicos terão menor energia e os elétrons estarão mais firmemente atraídos ao núcleo. Quanto maior a eletronegatividade, mais estável é o orbital atômico. Então, a eletronegatividade aumenta na linha da tabela periódica, o que faz sentido já que os gases nobres, átomos mais estáveis, estão na última coluna da direita.
Para ocorrer uma ligação covalente, a eletronegatividade dos átomos deve ser próxima. A eletronegatividade do nitrogênio é 3,04 e a do oxigênio é 3,44, possibilitando a ligação covalente mostrada na figura acima. Entretanto, quando átomos tem grande diferença de eletronegatividade, há a formação de uma ligação iônica, ou seja, o produto reacional é um sólido iônico. Isso ocorre entre o sódio que tem 0,93 de eletronegatividade e o cloro com 3,16 de eletronegatividade. Ou seja, o cloro é mais eletronegativo que o sódio, então o orbital atômico do cloro é menos energético e mais estável do que o orbital atômico do cloro. Isso pode ser confirmado pela distribuição eletrônica do cloro que são 17 elétrons distribuídos nos orbitais 1s, 2s, 2p, 3s, 3p, possuindo 5 elétrons no orbital atômico 3p; ou seja, falta apenas um elétron para que esse orbital fique completo. Já o sódio que possui 11 elétron distribuídos nos orbitais 1s, 2s, 2p, 3s, sendo que esse orbital 3s possui apenas 1 elétron.
Como o átomo de cloro possui 17 prótons, o núcleo dele atrai mais os elétrons (cloro é mais eletronegativo), então os orbitais atômicos do cloro são menos energéticos e mais estáveis. Já o átomo de sódio possui apenas 11 prótons e atrai menos os elétrons, então, os orbitais atômicos do sódio são muito mais energéticos que os do cloro e menos estáveis. Assim, quando um átomo de sódio se aproxima de um átomo de cloro, o único elétron do orbital 3s vai para o orbital atômico do cloro que é menos energético. Formando assim os íons Na+ e Cl–. Com a formação desses dois íons, ocorre atração eletrostática entre eles, formando uma ligação iônica, pois o a carga positiva do íon Na+ atrai a carga negativa do íon Cl–.
Orbital molecular com mais de dois átomos
Os orbitais sempre tendem a ficar o mais distantes entre si, pois são os elétrons que os compõem tem carga negativa e se repelem. A maior repulsão entre 4 orbitais é na disposição tetraédrica. O metano possui 1 carbono ligado a 4 hidrogênios em um arranjo tetraédrico, como essas quatro ligações iguais com ângulo de 109,5°.
Conhecendo a distribuição atômica do carbono que possui 6 elétrons: 1s2, 2 s2, 2p2 o carbono só poderia fazer 4 ligações com os elétrons do orbital atômico 2p2 , entretanto, os orbitais p ficam na direção x, y e z. Assim, não faz sentido existir um ângulo de 109,5º quando os eixos x, y e z tem ângulos de 90º entre si. Para alterar esse ângulo, temos que obter quatro orbitais iguais que terão o ângulo tetraédrico de 109,5º.
*Para resolvermos esse problema, temos que juntar os orbitais 2s com os orbitais 2px, 2py e 2pz. Produzindo assim 4 orbitais 2sp3 híbridos, podendo formar 4 ligações simples, ligações sigma (σ), em um arranjo tetraédrico. Essas ligações 25% (ou um quarto) de caráter s.
número de ligações
duplas
|
orbitais p
puros
|
orbitais
atômicos usados para hibridização
|
número de orbitais
híbridos
|
caráter s
|
geometria
|
0
|
0
|
s, p, p, p
|
4 orbitais sp3
|
1/4
|
tretraédrico
|
1
|
1
|
s, p, p
|
3 orbitais sp2
|
1/3
|
trigonal plano
|
2
|
2
|
sp
|
2 orbitais sp
|
1/2
|
linear
|
*Entretanto, se precisamos fazer uma ligação dupla, é necessário uma ligação pi (π) que é feita com um orbital p "puro", ou seja, um orbital p sem hibridizar. Assim, para que a molécula tenha uma ligação dupla, só podemos hibridizar dois orbitais p (para sobrar um p puro para a ligação π). Então, hibridizando dois orbitais p com um orbital s teremos três orbitais sp2. Logo, esse carbono com hibridização sp2 terá uma ligação π formada pelo orbital p puro e três ligações formadas por orbitais híbridos sp2 com um terço de caráter s em arranjo trigonal plano.
*Se o átomo faz duas ligações duplas, são necessários dois orbitais p puros, então ocorrerá apenas a hibridação de um orbital s com um orbital p, formando 2 orbitais sp; com 50% de caráter s em arranjo linear. O carbono sp terá duas ligações sigma (σ) feitas pelos orbitais híbridos sp e ligações duplas feitas por orbitais moleculares π a partir do orbital atômico p puro.
Uma informação importante sobre a ligação pi (π) é que ela não permite rotação, pois para girar elas perderiam a interação com os eixos perpendiculares, logo os alquenos não fazem rotação na ligação dupla, fato importante para os compostos cis e trans.
A movimentação dos átomos também pode movimentar a molécula como um todo, girando-a ou movimentando-a para um lado, para o outro, para cima e para baixo, para frente e para trás, nas diagonais... enfim, nas três dimensões.
Agora, uma movimentação importante, que temos que prestar atenção, é o movimento de átomos específicos dentro de uma molécula. Por exemplo, quando um átomo permite que suas ligações girem.
A ligação sigma permite rotação.
A ligação pi não permite rotação, pois ao girar ela perderia a conecção lateral que ela faz com o átomo ao lado. Veremos mais sobre isso nos próximos capítulos.
Atenção: o orbital híbrido é um orbital p com um dos lados menorzinho.
Lembrando que o carbono faz 4 ligações: na imagem abaixo, o primeiro carbono desenhado possui:
*um orbital p puro no eixo y (acima e abaixo do carbono) que fará a ligação pi da ligação dupla.
*um orbital sp2 entre os dois carbonos, fazendo a ligação sigma da ligação dupla.
*dois orbitais sp2 que farão duas ligações simples com outros átomos.
Outros átomos com hibridação sp
Assim como o carbono CH4 tem hibridação sp3 e arranjo tetraédrico, as moléculas
BH4– e NH4 + também possuem arranjo tetraédrico, sendo que nesse caso o boro (B) e o nitrogênio (N) hibridação sp3.
Já a molécula BH3 tem geometria trigonal plana e o boro (B) possui hibridação sp2, assim como o CH3 + que também tem geometria trigonal plana e o carbono tem hibridação sp2. Nesse caso, o orbital "p puro" fica acima e abaixo do triângulo, sem participar das ligações.
Movimentação dos átomos na molécula
As ligações não ficam paradas. Elas aumentam e diminuem de tamanho constantemente, vibrando. Pois os átomos estão em constante movimento. Isso pode ser comprovado pelo conceito de temperatura que é a energia cinética dos átomos. Assim, os átomos só estariam paradas a zero kelvin, ou seja 273 graus célcius. Como essa temperatura de exatamente zero graus kelvin nunca foi alcançada, podemos dizer que é quase impossível os átomos ficarem completamente parados. Assim, as ligações químicas esticam e contraem.A movimentação dos átomos também pode movimentar a molécula como um todo, girando-a ou movimentando-a para um lado, para o outro, para cima e para baixo, para frente e para trás, nas diagonais... enfim, nas três dimensões.
Agora, uma movimentação importante, que temos que prestar atenção, é o movimento de átomos específicos dentro de uma molécula. Por exemplo, quando um átomo permite que suas ligações girem.
A ligação sigma permite rotação.
A ligação pi não permite rotação, pois ao girar ela perderia a conecção lateral que ela faz com o átomo ao lado. Veremos mais sobre isso nos próximos capítulos.











Simplesmente sensacional! Muito bem feito e dá pra entender muito bem. Parabéns pelo trabalho.
ResponderExcluirMaterial de excelente qualidade, parabéns!
ResponderExcluirMaravilhoso. Parabéns.
ResponderExcluir